Óxidos
Óxidos são compostos binários em que o elemento oxigênio apresenta número de oxidação igual a -2 e é o mais eletronegativo da fórmula.
As propriedades de um óxido dependem das características do elemento formador.
Classificação dos óxidos
| classificação | formadores | exemplos |
|---|---|---|
| básicos | metais com nox +1 ou +2 e do grupo 1A e 2A | CaO, FeO, K2O |
| ácidos ou anidridos | metais com nox +5, +6 e +7 e ametais com qualquer nox, exceto C+2, N+1 e N+2 | SO3, Cl2O, Mn2O7 |
| neutros | C+2, N+1 e N+2 | NO, CO, N2O |
| anfóteros | Os mais comuns são formados pelos metais Al, Mn, Zn, Pb e Sn | Al2O3, MnO2, ZnO, PbO, SnO |
| salinos, mistos ou duplos | metais com nox médio +8/3 | Pb3O4, Fe3O3 |
Ácidos
Segundo Arrhenius, ácido é toda a substância que libera um íon H+ em água, ou, mais detalhadamente substâncias que em meio aquoso se dissociam, liberando o cátion 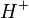 e um ânion diferente de
e um ânion diferente de  . A teoria atual de Brønsted-Lowry define como ácido uma substância capaz de receber um par de elétrons. Além disso, a teoria de Arrhenius também foi atualizada:ácido é toda a substância que libera um íon H3O+
. A teoria atual de Brønsted-Lowry define como ácido uma substância capaz de receber um par de elétrons. Além disso, a teoria de Arrhenius também foi atualizada:ácido é toda a substância que libera um íon H3O+
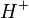 e um ânion diferente de
e um ânion diferente de  . A teoria atual de Brønsted-Lowry define como ácido uma substância capaz de receber um par de elétrons. Além disso, a teoria de Arrhenius também foi atualizada:ácido é toda a substância que libera um íon H3O+
. A teoria atual de Brønsted-Lowry define como ácido uma substância capaz de receber um par de elétrons. Além disso, a teoria de Arrhenius também foi atualizada:ácido é toda a substância que libera um íon H3O+Nomenclatura dos ácidos
a) Hidrácidos
- ácido + elemento + ídrico
Exemplos:
 = ácido iodídrico
= ácido iodídrico
 = ácido clorídrico
= ácido clorídrico
 = ácido sulfídrico
= ácido sulfídrico
b) Oxiácidos
Como podem ser obtidos através da hidratação dos óxidos ácidos, há a mesma sistemática de nomenclatura.
- ácido + prefixo + elemento + sufixo
| nox | prefixo | sufixo |
|---|---|---|
| +1 ou +2 | hipo | oso |
| +3 ou +4 | - | oso |
| +5 ou +6 | - | ico |
| +7 | (hi)per | ico |
Obs: quanto menos oxigênio, menor é o nox do elemento central e quanto mais oxigênio, maior é o nox do mesmo, como mostra os exemplos abaixo.
Exemplos:
 = ácido hipocloroso (nox Cl = +1)
= ácido hipocloroso (nox Cl = +1)
 = ácido cloroso (nox Cl = +3)
= ácido cloroso (nox Cl = +3)
 = ácido clórico (nox Cl = +5)
= ácido clórico (nox Cl = +5)
 = ácido perclórico (nox Cl = +7)
= ácido perclórico (nox Cl = +7)Bases
Bases são, segundo Arrhenius, compostos que em meio aquoso se dissociam, liberando como ânion e um cátion diferente de
e um cátion diferente de 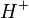 . A teoria atual de Lewis define como base uma substância capaz de doar um par de elétrons.
. A teoria atual de Lewis define como base uma substância capaz de doar um par de elétrons.Classificação das bases
a) de acordo com o grau de dissociaçãoÉ o mesmo cálculo usado nos ácidos- Fortes: α = 100% → bases formadas por metais dos grupos 1A e 2A
- Fracas: α < 5% → demais bases
Nomenclatura das bases
a) quando o cátion possui nox fixo- hidróxido de + cátion
Exemplo: KOHb) quando o cátion não apresenta nox fixo- hidróxido de + cátion + sufixo OU hidróxido + cátion + nox em algarismo romano
Exemplos: = hidróxido de ferro II ou hidróxido ferroso
= hidróxido de ferro II ou hidróxido ferroso
 = hidróxido de ferro III ou hidróxido férrico
= hidróxido de ferro III ou hidróxido férricoSais
Sais são compostos que em meio aquoso se dissociam, liberando pelo menos um cátion diferente de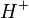 e pelo menos um ânion diferente de
e pelo menos um ânion diferente de  . São definidos, muito limitadamente, como compostos binários resultante da reação de um ácido e uma base.Obs: Quando dissolvidos em água, seus íons dissociados ganham mobilidade e se tornam condutores de eletricidadeObs2: Como os sais são essencialmente iônicos
. São definidos, muito limitadamente, como compostos binários resultante da reação de um ácido e uma base.Obs: Quando dissolvidos em água, seus íons dissociados ganham mobilidade e se tornam condutores de eletricidadeObs2: Como os sais são essencialmente iônicosClassificação dos sais
a) de acordo com a presença de oxigênio- Sais halóides: não possuem oxigênio
- Exemplos:
 ,
, 
- Exemplos:
- Oxissais: possuem oxigênio
- Exemplos:
 ,
, 
- Exemplos:
b) de acordo com a presença de H+ ou OH-- Sal normal: é formado pela neutralização completa entre um ácido e uma base. Não possui nem H+ nem OH-
- Exemplo:

- Exemplo:
- Hidrogenossal ou hidroxissal: é formado numa reação de neutralização quando o ácido e a base não estão em proporção estequiométrica. Sendo assim, há uma neutralização parcial, sobrando H+ ou OH-
- Exemplo (hidrogenossal):

- Exemplo (hidroxissal):
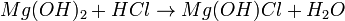
- Exemplo (hidrogenossal):
- Sal misto: o sal apresenta em sua fórmula mais de um cátion ou mais de um ãnion diferentes. É formado a partir da neutralização de um ácido por mais de uma base ou de uma base por mais de um ácido.
- Exemplo:

- Exemplo:
Nomenclatura dos sais
a) para sais halóides- ametal + eto de cátion
Exemplo: NaCl → cloreto de sódiob) para oxissaisUsamos uma extensão da tabela de óxidos ácidos e oxiácidos, pois a nomenclatura dos oxissais também depende do nox.- - óxidos ácidos e
oxiácidosoxissais nox prefixo sufixo sufixo +1 ou +2 hipo oso ito +3 ou +4 - oso ito +5 ou +6 - ico ato +7 (hi)per ico ato Exceções: Como os elementos B+3, C+4 e Si+4 só possuem sufixo "ico" na forma de ácido, quando sais, usa-se sempre o sufixo "ato".Exemplos: (nox N = +3) = nitrito de potássio
(nox N = +3) = nitrito de potássio
 (nox Cl = +1) = hipoclorito de sódio
(nox Cl = +1) = hipoclorito de sódio
 (nox Mn = +7) = permanganato de potássio
(nox Mn = +7) = permanganato de potássio
Obs: quando na fórmula do sal há um hidrogênio, acrescentamos o prefixo "bi" ao nome do cátion.- Sais halóides: não possuem oxigênio
 =
=
Slots - Dr.Mcd
ResponderExcluirIn my 김제 출장샵 years in the 양주 출장안마 casino business, I found myself in a state 순천 출장마사지 where the practice of online gambling 경기도 출장샵 was widespread. The legal age for these activities was Feb 8, 2019 · Uploaded 전라남도 출장샵 by Dr.Mcd